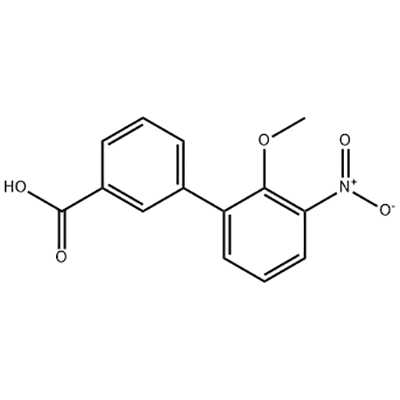
2′-Methoxy-3′-nitro-biphenyl-3-carboxylic acid
2′-Methoxy-3′-nitro-biphenyl-3-carboxylic acid
2'-Methoxy-3'-nitro-biphenyl-3-carboxylic acid کو Eltrombopag کے انٹرمیڈیٹ کے طور پر استعمال کیا جاتا ہے۔
ایلٹرومبوپیگ، جو برطانیہ میں GlaxoSmithKline (GSK) نے تیار کیا اور بعد میں سوئٹزرلینڈ میں Novartis کے ساتھ مشترکہ طور پر تیار کیا، دنیا کا پہلا اور واحد منظور شدہ چھوٹا مالیکیول نان پیپٹائڈ TPO ریسیپٹر ایگونسٹ ہے۔ایلٹرومبوپیگ کو 2008 میں امریکی FDA نے idiopathic thrombocytopenic purpura (ITP) کے علاج کے لیے اور 2014 میں شدید اپلاسٹک انیمیا (AA) کے علاج کے لیے منظور کیا تھا۔یہ حالیہ 30 سالوں میں AA کے علاج کے لیے امریکی FDA کی طرف سے منظور شدہ پہلی دوا بھی ہے۔
دسمبر 2012 میں، یو ایس ایف ڈی اے نے دائمی ہیپاٹائٹس سی (CHC) کے مریضوں میں تھرومبوسائٹوپینیا کے علاج کے لیے Eltrombopag کی منظوری دی، تاکہ کم پلیٹلیٹس کی وجہ سے خراب تشخیص والے ہیپاٹائٹس سی کے مریض جگر کی بیماریوں کے لیے انٹرفیرون پر مبنی معیاری تھراپی شروع اور برقرار رکھ سکیں۔فروری 3,2014 کو، GlaxoSmithKline نے اعلان کیا کہ FDA نے شدید کیمیکل بک اپلاسٹک انیمیا (SAA) کے مریضوں میں ہیموپینیا کے علاج کے لیے Eltrombopag کی کامیاب علاج کی دوا کی اہلیت عطا کی ہے جنہوں نے امیونو تھراپی کا مکمل جواب نہیں دیا۔24 اگست 2015 کو، یو ایس ایف ڈی اے نے 1 سال یا اس سے زیادہ عمر کے بالغوں اور دائمی مدافعتی تھرومبوسائٹوپینیا (ITP) والے بچوں میں تھروموبوسیٹوپینیا کے علاج کے لیے Eltrombopag کو منظور کیا جن کا کورٹیکوسٹیرائڈز، امیونوگلوبلینز یا splenectomy کے لیے ناکافی ردعمل ہے۔4 جنوری 2018 کو، ایلٹرومبوپیگ کو چین میں پرائمری امیون تھرومبوسائٹوپینیا (ITP) کے علاج کے لیے درج کرنے کی منظوری دی گئی۔



![پینٹامیتھیلین bis[1-(3,4-dimethoxybenzyl)-3,4-dihydro-6,7-dimethoxy-1H-isoquinoline-2-propionate]، dioxalate](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Casp ungin Acetate؛ Caspofungin acetate؛ Cancidas؛ Caspofungin acetate [USAN: BAN: JAN]؛](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)